Автор:
Florence Bailey
Жасалған Күн:
21 Сапта Жүру 2021
Жаңарту Күні:
1 Шілде 2024
Мазмұны
- Қадамдар
- 2 -ші әдіс 1: Д.И.Менделеевтің периодтық жүйесін қолдана отырып электрондардың таралуы
- 2 -ші әдіс 2: ADOMAH периодтық кестесін қолдану
- Кеңестер
Электрондық конфигурация атом - оның электронды орбитальдарының сандық көрінісі. Электрондық орбитальдар - бұл электронды математикалық ықтимал атом ядросының айналасында орналасқан әр түрлі пішіндегі аймақтар. Электрондық конфигурация оқырманға атомның қанша электронды орбитальдары бар екенін тез әрі оңай айтуға, сондай -ақ әрбір орбитальдағы электрондардың санын анықтауға көмектеседі. Бұл мақаланы оқығаннан кейін сіз электронды конфигурацияларды құру әдісін меңгерген боласыз.
Қадамдар
2 -ші әдіс 1: Д.И.Менделеевтің периодтық жүйесін қолдана отырып электрондардың таралуы
 1 Өз атомыңыздың атомдық нөмірін табыңыз. Әр атомда электрондардың белгілі бір саны болады. Периодтық кестеде атомның таңбасын табыңыз. Атом нөмірі - 1 -ден басталатын оң бүтін сан (сутегі үшін) және әрбір келесі атом үшін бір -ге көбейеді. Атом нөмірі - бұл атомдағы протондар саны, сондықтан бұл зарядтары нөлге тең атомдардағы электрондар саны.
1 Өз атомыңыздың атомдық нөмірін табыңыз. Әр атомда электрондардың белгілі бір саны болады. Периодтық кестеде атомның таңбасын табыңыз. Атом нөмірі - 1 -ден басталатын оң бүтін сан (сутегі үшін) және әрбір келесі атом үшін бір -ге көбейеді. Атом нөмірі - бұл атомдағы протондар саны, сондықтан бұл зарядтары нөлге тең атомдардағы электрондар саны. - 2 Атом зарядын анықтаңыз. Бейтарап атомдарда периодтық кестеде көрсетілгендей электрондар болады. Алайда, зарядталған атомдарда заряд мөлшеріне байланысты көп немесе аз электрон болады. Егер сіз зарядталған атоммен жұмыс жасасаңыз, электрондарды төмендегідей қосыңыз немесе азайтыңыз: әр теріс зарядқа бір электронды қосыңыз және әрбір оң зарядқа біреуін алып тастаңыз.
- Мысалы, заряды -1 болатын натрий атомында қосымша электрон болады қосымша оның негізгі атомдық нөмірі 11. Басқаша айтқанда, жалпы атомда 12 электрон болады.
- Егер біз +1 заряды бар натрий атомы туралы айтатын болсақ, онда 11 негізгі атом нөмірінен бір электронды алып тастау керек. Осылайша, атомда 10 электрон болады.
- 3 Орбитальдардың негізгі тізімін есте сақтаңыз. Электрондар саны көбейген сайын олар белгілі бір реттілік бойынша атомның электронды қабығының әр түрлі деңгейлерін толтырады. Электрон қабығының әрбір ішкі деңгейінде толтырылған кезде электрондардың жұп саны болады. Келесі ішкі деңгейлер қол жетімді:
- s-деңгей (электронды конфигурациядағы «с» әрпінен бұрын келетін кез келген сан) бір орбиталды қамтиды және сәйкес Паули принципі, бір орбитальда максимум 2 электрон болуы мүмкін, сондықтан электронды қабықтың әрбір s-қосалқы деңгейінде 2 электрон болуы мүмкін.
- p-деңгейлік құрамында 3 орбиталь бар, сондықтан максимум 6 электрон болуы мүмкін.
- d-деңгейлік құрамында 5 орбиталь бар, сондықтан 10 электронға дейін болуы мүмкін.
- f-деңгейлік құрамында 7 орбиталь бар, сондықтан оның 14 электронға дейін болуы мүмкін.
- g-, h-, i- және k-ішкі деңгейлері теориялық болып табылады Бұл орбитальдарда электрондары бар атомдар белгісіз. G деңгейінің құрамында 9 орбиталь бар, сондықтан теориялық тұрғыдан алғанда 18 электрон болуы мүмкін. H-sublevel 11 орбиталь және максимум 22 электрон болуы мүмкін; i -деңгейдегі -13 орбитальда және максимум 26 электрон; k -деңгей деңгейінде - 15 орбиталь және максимум 30 электрон.
- Мнемоникалық трюктің көмегімен орбитальдардың ретін жаттаңыз:
С.Обер Пгисиктер Dжоқ Fинд Г.ирафалар Hбос тұру Менn Қиттер (байсалды физиктер асханада жасырынған жирафтарды таппайды).
- 4 Электрондық конфигурация жазбасын түсіну. Электрондық конфигурациялар әрбір орбитальдағы электрондардың санын нақты көрсету үшін жазылады. Орбитальдар кезекпен жазылады, әр орбитальдағы атомдар саны орбиталық атаудың оң жағында жазылады. Аяқталған электронды конфигурация ішкі деңгей мен жоғарғы жазулардың реттілігі түрінде болады.
- Мысалы, ең қарапайым электронды конфигурация: 1s 2s 2p. Бұл конфигурация 1s қосалқы деңгейінде екі электрон, 2s қосалқы деңгейінде екі электрон және 2p қосалқы деңгейінде алты электрон бар екенін көрсетеді. 2 + 2 + 6 = барлығы 10 электрон. Бұл бейтарап неон атомының электрондық конфигурациясы (неонның атомдық нөмірі 10).
- 5 Орбитальдардың орналасу ретін есте сақтаңыз. Есіңізде болсын, электронды орбитальдар электрон қабығының санының өсу ретімен, бірақ энергияның өсу ретімен нөмірленеді. Мысалы, толтырылған 4s орбиталы ішінара толтырылған немесе толтырылған 3d -ге қарағанда энергиялы емес (немесе аз қозғалатын), сондықтан 4s орбиталы алдымен жазылады. Орбитальдардың орналасу ретін білген соң, оларды атомдағы электрондардың санына қарай оңай толтыруға болады. Орбитальдарды толтыру тәртібі келесідей: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Барлық орбитальдар толтырылған атомның электрондық конфигурациясы келесі түрде болады: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Назар аударыңыз, барлық орбитальдар толтырылған кезде жоғарыдағы жазба Uuo (ununoctium) 118 электронды конфигурациясы болып табылады, бұл периодтық жүйедегі ең көп нөмірленген атом. Сондықтан бұл электронды конфигурацияда бейтарап зарядталған атомның қазіргі кездегі барлық электронды деңгейлері бар.
- 6 Орбитальдарды атомыңыздағы электрондардың санына сәйкес толтырыңыз. Мысалы, егер біз бейтарап кальций атомының электрондық конфигурациясын жазғымыз келсе, онда оның атомдық нөмірін периодтық кестеден іздеуден бастау керек. Оның атомдық нөмірі 20, сондықтан біз 20 электроны бар атомның конфигурациясын жоғарыдағы тәртіп бойынша жазамыз.
- Орбитальдарды жиырмасыншы электронға жеткенше жоғарыдағы ретпен толтырыңыз. Алғашқы 1s орбитальында екі электрон болады, 2с орбитальдарында екі, 2p - алты, 3s - екі, 3p - 6 және 4s - 2 болады (2 + 2 + 6 +2 + 6 + 2 = 20.) Басқаша айтқанда, кальцийдің электрондық конфигурациясы: 1s 2s 2p 3s 3p 4s.
- Орбитальдар энергияның өсу тәртібінде екенін ескеріңіз. Мысалы, сіз 4 -ші энергетикалық деңгейге өтуге дайын болғанда, алдымен 4s орбитальды жазыңыз, және онда 3d. Төртінші энергетикалық деңгейден кейін сіз бесіншіге барасыз, онда сол тәртіп қайталанады. Бұл үшінші энергия деңгейінен кейін ғана болады.
- 7 Периодтық кестені көрнекі ақпарат ретінде пайдаланыңыз. Сіз периодтық кестенің пішіні электронды конфигурациядағы электронды деңгейлердің ретіне сәйкес келетінін байқаған шығарсыз. Мысалы, сол жақтағы екінші бағандағы атомдар әрқашан «с» -мен аяқталады, ал жіңішке ортаңғы қиманың оң жақ шетіндегі атомдар әрқашан «d» әрпімен аяқталады және т.б. Периодтық кестені конфигурацияларды жазудың көрнекі нұсқауы ретінде пайдаланыңыз - орбитальдарды қосу реті кестедегі ұстанымыңызға сәйкес келеді. Төменде қараңыз:
- Атап айтқанда, сол жақтағы екі бағанда электронды конфигурациялары s-орбитальдармен аяқталатын атомдар бар, кестенің оң блогында конфигурациялары p-орбитальдармен аяқталатын атомдар бар, ал төменгі бөлігінде атомдар f-орбитальдармен аяқталады.
- Мысалы, хлордың электронды конфигурациясын жазғанда, мынаны ойлаңыз: «Бұл атом периодтық кестенің үшінші қатарында (немесе» периодында «) орналасқан. Ол сонымен қатар p орбитальды блоктың бесінші тобында орналасқан. периодтық жүйенің.Сондықтан оның электронды конфигурациясы ..3б аяқталады
- Назар аударыңыз: кестенің d және f орбитальдары аймағындағы элементтер олар орналасқан кезеңге сәйкес келмейтін энергия деңгейлерімен сипатталады. Мысалы, d-орбитальдары бар элементтер блогының бірінші қатары 3-ші орбитальдарға сәйкес келеді, бірақ ол 4-ші периодта орналасқан, ал f-орбитальдары бар элементтердің бірінші қатары 4f орбитальына сәйкес келеді. 6 -шы кезеңде.
- 8 Ұзын электрондық конфигурацияларды жазудың стенографиясын біліңіз. Периодтық жүйенің оң жақ шетіндегі атомдар деп аталады асыл газдар. Бұл элементтер химиялық жағынан өте тұрақты. Ұзақ электронды конфигурацияларды жазу процесін қысқарту үшін жай ғана жақшаның ішіне атомнан аз электроны бар жақын газдың химиялық таңбасын жазыңыз, содан кейін келесі орбиталық деңгейлердің электронды конфигурациясын жазуды жалғастырыңыз. Төменде қараңыз:
- Бұл ұғымды түсіну үшін конфигурация мысалын жазу пайдалы. Асыл газ аббревиатурасын қолданып, мырыштың конфигурациясын (атомдық нөмірі 30) жазайық. Мырыштың толық конфигурациясы келесідей: 1s 2s 2p 3s 3p 4s 3d. Алайда, біз 1s 2s 2p 3s 3p - бұл аргонның электронды конфигурациясы, асыл газ. Мырыштың электронды конфигурация бөлігін шаршы жақшалардағы химиялық таңбамен аргонмен ауыстырыңыз ([Ar].)
- Сонымен, мырыштың электронды конфигурациясы қысқартылған түрде жазылған: [Ar] 4s 3d.
- Назар аударыңыз, егер сіз асыл газдың электронды конфигурациясын жазсаңыз, айталық, аргон, сіз [Ar] жаза алмайсыз! Осы элементке қарайтын асыл газды азайтуды қолдану керек; аргон үшін неон болады ([Не]).
2 -ші әдіс 2: ADOMAH периодтық кестесін қолдану
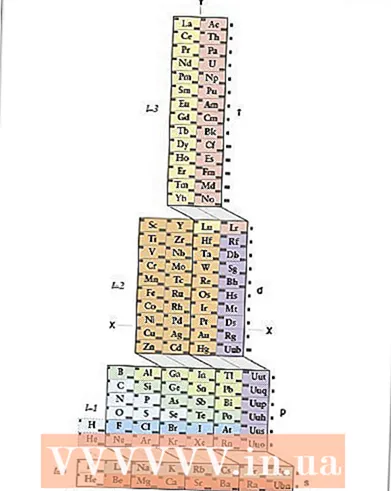
 1 ADOMAH периодтық кестесін біліңіз. Электрондық конфигурацияны жазудың бұл әдісі есте сақтауды қажет етпейді, алайда оған қайта қаралған периодтық кесте қажет, өйткені дәстүрлі периодтық кестеде төртінші кезеңнен бастап период нөмірі электронды қабыққа сәйкес келмейді. ADOMAH периодтық кестесін табыңыз - ғалым Валерий Циммерман жасаған периодтық жүйенің ерекше түрі. Интернетте қысқа іздеу арқылы оны табу оңай.
1 ADOMAH периодтық кестесін біліңіз. Электрондық конфигурацияны жазудың бұл әдісі есте сақтауды қажет етпейді, алайда оған қайта қаралған периодтық кесте қажет, өйткені дәстүрлі периодтық кестеде төртінші кезеңнен бастап период нөмірі электронды қабыққа сәйкес келмейді. ADOMAH периодтық кестесін табыңыз - ғалым Валерий Циммерман жасаған периодтық жүйенің ерекше түрі. Интернетте қысқа іздеу арқылы оны табу оңай. - ADOMAH периодтық кестесінде көлденең жолдар галогендер, асыл газдар, сілтілік металдар, сілтілі жер металдары және т.б элементтер тобын білдіреді. Тік бағандар электронды деңгейлерге сәйкес келеді, ал «каскадтар» деп аталатындар (s, p, d және f блоктарын қосатын диагональды сызықтар) периодтарға сәйкес келеді.
- Гелий сутекке ауысады, себебі бұл екі элементтің де 1s орбиталы бар. Оң жақта периодтық блоктар (s, p, d және f), ал төменгі жағында деңгейлік сандар көрсетілген. Элементтер 1 -ден 120 -ға дейінгі ұяшықтарда көрсетілген. Бұл сандар бейтарап атомдағы электрондардың жалпы санын білдіретін ортақ атомдық сандар.
- 2 ADOMAH кестесінен атомды табыңыз. Элементтің электрондық конфигурациясын жазу үшін ADOMAH периодтық кестесінен оның таңбасын тауып, атомдық нөмірі жоғары барлық элементтерді сызып тастаңыз. Мысалы, егер эрбиумның (68) электронды конфигурациясын жазу қажет болса, 69 -дан 120 -ға дейінгі барлық элементтерді сызып тастаңыз.
- Кестенің төменгі жағындағы 1 -ден 8 -ге дейінгі сандарға назар аударыңыз. Бұл электронды деңгей нөмірлері немесе баған нөмірлері. Тек сызылған элементтері бар бағандарды елемеңіз.Эрбиум үшін 1, 2, 3, 4, 5 және 6 нөмірленген бағандар қалады.
- 3 Элементтің орбиталық ішкі деңгейлерін есептеңіз. Кестенің оң жағында көрсетілген блок таңбаларына (s, p, d және f) және төменгі жағында көрсетілген баған нөмірлеріне қарап, блоктар арасындағы диагональды сызықтарды елемеңіз және бағандарды төменнен баған блоктарына бөліңіз. жоғарыға. Тағы да, барлық элементтері сызылған қораптарды елемеңіз. Баған блоктарын баған нөмірінен бастап блок белгісінен бастап жазыңыз, осылайша: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (эрбиум үшін).
- Ескерту: Жоғарыда көрсетілген Er электронды конфигурациясы электрондық деңгей деңгейінің өсу ретімен жазылған. Оны орбитальдарды толтыру ретімен де жазуға болады. Ол үшін баған блоктарын жазғанда каскадтарды бағандарға емес, төменнен жоғары қарай орындаңыз: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- 4 Әрбір электронды деңгейдің электрондарын санаңыз. Әр элементтен бір электронды байланыстыра отырып, әр блок-бағандағы элементтерді санап, олардың санын әрбір блок-бағанға арналған блок таңбасының жанына келесі түрде жазыңыз: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6с ... Біздің мысалда бұл эрбиумның электрондық конфигурациясы.
- 5 Дұрыс емес электрондық конфигурацияларды қарастырыңыз. Энергияның ең төменгі күйіндегі атомдардың электрондық конфигурациясына қатысты он сегіз типтік ерекшеліктер бар, оларды жердің энергетикалық күйі деп те атайды. Олар электрондардың соңғы екі -үш позициясында ғана жалпы ережеге бағынбайды. Бұл жағдайда нақты электронды конфигурация электрондардың атомның стандартты конфигурациясымен салыстырғанда энергиясы төмен күйде екенін болжайды. Ерекше атомдарға мыналар жатады:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Мо (..., 4d5, 5s1); Ру (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); Ла (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Ау (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Па (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) және См (..., 5f7, 6d1, 7s2).
Кеңестер
- Электрондық конфигурацияда жазылған кезде атомның нөмірін табу үшін әріптерден кейінгі барлық сандарды (s, p, d және f) қосыңыз. Бұл тек бейтарап атомдар үшін жұмыс істейді, егер сіз ионмен жұмыс жасасаңыз, онда ештеңе болмайды - сізге қосымша немесе жоғалған электрондардың санын қосу немесе азайту керек.
- Әріптен кейінгі нөмір - жоғарғы жол, тексеруде қателеспеңіз.
- «Жартылай толтырылған тұрақтылық» жоқ. Бұл жеңілдету. «Жартылай толтырылған» ішкі деңгейлерге қатысты кез келген тұрақтылық әрбір орбитальды бір электрон алатындығымен байланысты, сондықтан электрондар арасындағы итерілу барынша азайтылады.
- Әрбір атом тұрақты күйге ұмтылады, ал ең тұрақты конфигурациялар s және p (s2 және p6) ішкі деңгейлерін толтырады. Асыл газдардың мұндай конфигурациясы бар, сондықтан олар реакцияға сирек енеді және периодтық кестеде оң жақта орналасқан. Сондықтан, егер конфигурация 3p-де аяқталса, онда оған тұрақты күйге жету үшін екі электрон қажет болады (алтауын жоғалту үшін, s-деңгейінің электрондарын қосқанда, көбірек энергия қажет, сондықтан төртеуін жоғалту оңай). Егер конфигурация 4d -де аяқталса, онда тұрақты күйге жету үшін оған үш электронды жоғалту қажет. Сонымен қатар, жартылай толтырылған ішкі деңгейлер (s1, p3, d5 ..), мысалы, p4 немесе p2 қарағанда тұрақты; алайда s2 және p6 одан да берік болады.
- Егер сіз ионмен жұмыс жасасаңыз, бұл протондар саны электрондардың санына тең емес екенін білдіреді. Бұл жағдайда атом заряды химиялық таңбаның жоғарғы оң жағында (әдетте) көрсетіледі. Демек, +2 заряды бар сурьма атомы 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p электронды конфигурациясына ие. 5p 5p -ге өзгергенін ескеріңіз. Бейтарап атомның конфигурациясы s және p -ден басқа ішкі деңгейлерде аяқталғанда абай болыңыз. Электрондарды алған кезде оларды валенттік орбитальдардан ғана алуға болады (s және p орбитальдары).Сондықтан, егер конфигурация 4s 3d аяқталса және атом +2 зарядқа ие болса, онда конфигурация 4s 3d аяқталады. Назар аударыңыз, 3d жоқ s-орбитальдық электрондарды жоғалтудың орнына өзгереді.
- Электронды «жоғары энергия деңгейіне көтерілуге» мәжбүр ететін жағдайлар бар. Қосалқы деңгейге бір электрон жетіспегенде, жартылай немесе толық толтыруға дейін бір электронды ең жақын деңгейден алыңыз немесе оны электронды қажет ететін деңгейге жылжытыңыз.
- Электрондық конфигурацияны жазудың екі нұсқасы бар. Оларды энергия деңгейінің сандарының өсу ретімен немесе электронды орбитальдардың толтырылу ретімен жазуға болады, жоғарыда эрбиум үшін көрсетілгендей.
- Сондай -ақ, элементтің электронды конфигурациясын валенттік конфигурациясын жазу арқылы жазуға болады, ол соңғы s және p ішкі деңгейлері. Осылайша, сурьманың валенттік конфигурациясы 5s 5p формасына ие болады.
- Жүніс бұрынғыдай емес. Олармен әлдеқайда қиын. Екі деңгейден өтіп, сіз қай жерден бастағаныңызға және электрондардың санына байланысты сол үлгі бойынша жүріңіз.