Автор:
Lewis Jackson
Жасалған Күн:
8 Мамыр 2021
Жаңарту Күні:
25 Маусым 2024
Мазмұны
Таза иондық теңдеу химияның маңызды бөлігі болып табылады, өйткені ол химиялық реакцияда өзгеретін бөлшектерді ғана білдіреді. Олар көбінесе тотығу-тотықсыздану реакцияларында, метаболизм реакцияларында және қышқылдар - негіздердің бейтараптану реакцияларында қолданылады. Таза иондық теңдеуді жазудың үш негізгі қадамы бар: молекулалық теңдеуді теңдестіру, оны толық иондық теңдеуге айналдыру (әр зат ерітіндіде қалай болатынын) және соңында таза иондық теңдеуді жазу.
Қадамдар
2-ден 1-бөлім: Иондық теңдеудің компоненттерін түсіну
Молекулалар мен арасындағы айырмашылықты білу иондық қосылыстар. Таза иондық теңдеуді жазудың алғашқы қадамы - реакциядағы иондық қосылыстарды анықтау. Иондық қосылыстар дегеніміз - су ерітіндісінде иондарды диссоциациялайтын және электр заряды бар қосылыстар. Молекулалық қосылыстар дегеніміз - ешқашан электр заряды жоқ қосылыстар. Олар екі бейметалл арасында түзіледі және кейде ковалентті қосылыстар деп аталады.
- Иондық қосылыстар металдар мен бейметалдар, металдар мен көп атомды иондар немесе бірнеше көп атомды иондар арасында түзілуі мүмкін.
- Егер қосылыстың не екеніне сенімді болмасаңыз, онда осы қосылыстың элементтерін периодтық жүйеден іздеуге болады.

Қосылыстың ерігіштігін тану. Иондық қосылыстардың барлығы бірдей судағы ерітіндіде ерімейді, сондықтан иондарда диссоциациялануы мүмкін емес. Қалған теңдеуге кіріспес бұрын әр қосылыстың ерігіштігін анықтау керек. Төменде ерігіштік ережелерінің қысқаша мазмұны келтірілген. Толығырақ ақпарат пен осы ережелерден өзгеше жағдайлар үшін ерігіштік кестесін табыңыз.- Осы ережелерді төменде көрсетілген тәртіппен орындаңыз:
- Барлық Na, K және NH тұздары4 барлығы ериді.
- Барлық тұздар ЖОҚ3, C2H3O2, ClO3, және ClO4 барлығы ериді.
- Барлық Ag, Pb және Hg тұздары2 барлығы ериді.
- Барлық Cl, Br және I тұздары ериді.
- Барлық CO тұздары3, O, S, OH, PO4, CrO4, Cr2O7, солай3 еріген (бірнеше жағдайларды қоспағанда).
- Барлық SO тұздары4 еріген (бірнеше жағдайларды қоспағанда).
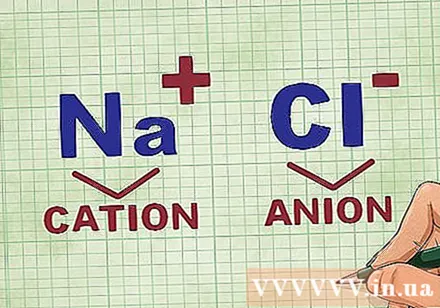
Қосылыстағы катиондар мен аниондарды анықтау. Катиондар қосылыстың оң иондары болып табылады және әдетте металл болып табылады. Анион қосылыстағы теріс ион болып табылады және металл емес. Кейбір бейметалдар катиондар түзе алады, бірақ металдар әрқашан катиондар түзеді.- Мысалы, NaCl-де Na оң зарядталған катион, себебі ол металл, ал Cl теріс зарядталған анион, өйткені ол металл емес.

Реакциядағы полиатомдық иондарды тану. Полиатомды иондар - өзара тығыз байланысқан және химиялық реакциялар кезінде диссоциацияланбайтын зарядталған молекулалар. Полиатомды иондарды тану өте маңызды, өйткені олар белгілі бір зарядқа ие және диссоциацияланбайды. Полиатомды иондар оң немесе теріс зарядқа ие болуы мүмкін.- Егер сіз жалпы химияны оқып жатсаңыз, онда көбінесе кейбір қарапайым көп атомды иондарды есте сақтау қажет.
- Кейбір жалпы полиатомдық иондар CO болып табылады3, ЖОҚ3, ЖОҚ2, SO4, SO3, ClO4 және ClO3.
- Сондай-ақ, көптеген басқа иондарды химиядан немесе интернеттен таба аласыз.
2-нің 2-бөлімі: Таза иондық теңдеу жазу
Баланс молекулалық теңдеулер. Таза иондық теңдеуді жазбас бұрын, сіздің молекулалық теңдеуіңіз теңдестірілген екеніне көз жеткізуіңіз керек. Теңдеуді теңдестіру үшін қосылыстың алдына әр элементтің атомдық саны теңдеудің екі жағында тең болатындай коэффициенттер қосасыз.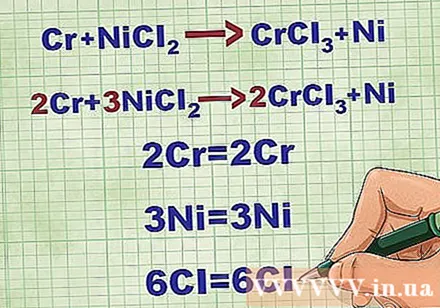
- Теңдеудің екі жағындағы әр қосылысты құрайтын атомдардың санын жаз.
- Әр жағын теңестіру үшін оттегі мен сутектен басқа элементтердің алдына коэффициент қосыңыз.
- Сутегі атомының балансы.
- Оттегінің атомдық балансы.
- Теңдеудің әр жағындағы атомдардың санын олардың теңдестірілгендігіне көз жеткізу үшін қайта санаңыз.
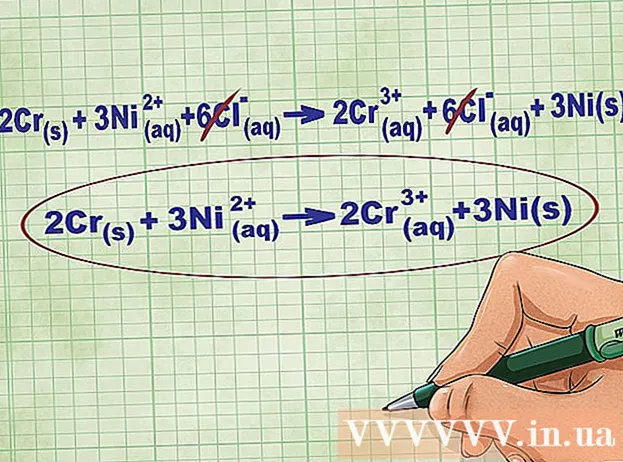
- Мысалы, Cr + NiCl2 -> CrCl3 + Ni 2Cr + 3NiCl дейін теңдестірілген2 -> 2CrCl3 + 3Ni.
Теңдеудегі қосылыстың күйін анықтаңыз. Мәселеде әр қосылыстың күйін білуге мүмкіндік беретін кілт сөздер көп кездеседі. Элементтің немесе қосылыстың күйін анықтауға көмектесетін бірнеше ережелер бар.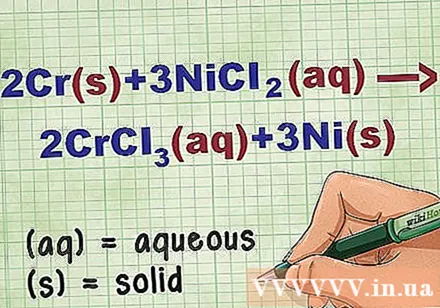
- Егер элемент үшін күй берілмесе, периодтық жүйеде табылған күйді қолданыңыз.
- Егер қосылыс ерітінді деп аталса, оны сулы немесе (dd).
- Егер теңдеуде су болса, онда ерігіштік кестесін пайдаланып, иондық қосылыстың суда еритіндігін анықтау керек. Егер ерігіштігі жоғары болса, қосылыс сулы болады (dd), егер ерігіштігі аз болса, қосылыс қатты болады (р).
- Сусыз иондық қосылыс қатты (р).
- Егер мәселе қышқыл немесе негізді болса, онда қосылыс сулы болады (dd).
- Мысалы, 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Cr және Ni элементтік формалары қатты күйде болады. NiCl2 және CrCl3 иондық қосылыстар ериді, сондықтан олар сулы. Теңдеуді келесідей етіп жазыңыз: 2Cr(р) + 3NiCl2(dd) -> 2CrCl3(dd) + 3Ni(р).
Ерітіндіде қандай қосылыстар диссоциацияланатынын (катиондар мен аниондарға диссоциацияланатын) анықтаңыз. Зат немесе қосылыс диссоциацияланған кезде оң зарядталған ионға (катион) және теріс зарядталған ионға (анионға) бөлінеді. Бұл таза иондық теңдеудің соңында теңестірілетін компоненттер.
- Қатты денелер, сұйықтықтар, газдар, молекулалық қосылыстар, төмен еритін иондық қосылыстар, көп атомды иондар мен әлсіз қышқылдар диссоциацияланбайды.
- Иондық қосылыстардың ерігіштігі жоғары (ерігіштік кестесін қолданыңыз), ал күшті қышқылдар 100% иондалады (HCl)(dd), HBr(dd), HI(dd), H2СО4(dd), HClO4(dd), және HNO3(dd)).
- Полиатомдық иондар бұдан әрі диссоциацияланбағанымен, егер олар осы қосылыстың құрамдас бөлігі болса, олар қосылыстың құрамынан бөлінетіндігін ескеріңіз.
Қосылыстардан диссоциацияланған әрбір ионның зарядын есептеңіз. Есіңізде болсын, металдар оң иондар, ал бейметалдар теріс иондар түзеді. Элементтің зарядын анықтау үшін периодтық кестені қолданыңыз. Сондай-ақ, қосылыстағы әр ионның зарядын теңестіру керек.
- Бұл мысалда NiCl2 CrCl кезінде Ni мен Cl-қа диссоциацияланған3 Cr және Cl бөлінеді.
- Ni заряды 2+ құрайды, өйткені Cl теріс заряды бір, бірақ 2 атомы бар. Сондықтан біз 2 теріс Cl ионын теңестіруіміз керек. Cr 3+ заряды бар, сондықтан біз 3 теріс Cl ионын теңестіруіміз керек.
- Полиатомдық иондардың белгілі бір заряды бар екенін ұмытпаңыз.
Толық иондық теңдеуді жазыңыз. Диссоциацияланатын немесе ионданатын кез-келген нәрсе (күшті қышқылдар) екі бөлек ионға бөлінеді. Заттың күйі қалады (dd), бірақ теңдеудің теңдестірілген болып тұрғанына көз жеткізіңіз.
- Қатты денелер, сұйықтықтар, газдар, әлсіз қышқылдар және төмен еритін иондық қосылыстар күйін өзгертпейді немесе иондарға бөлінеді. Біз оларды бүтін күйінде сақтаймыз.
- Молекулалық заттар ерітіндіде таралады, сондықтан олардың күйі өзгереді (dd). Үш ерекшелік емес болу (dd): CH4(к), C3H8(к)және C8H18(л).
- Жоғарыдағы мысалды жалғастыра отырып, толық иондық теңдеу келесідей болады: 2Cr(р) + 3Ni(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3Ni(р). Cl қосылыста болмаса, ол биполярлы болмайды, сондықтан теңдеудің екі жағында 6 Cl ионын алу үшін коэффициентті қосылыстағы атомдар санына көбейтеміз.
Теңдеудің әр жағында бірдей иондарды жою арқылы тепе-теңдік иондарын алып тастаңыз. Егер олар екі жағынан бірдей болса ғана зарядты жоюға болады (заряд, атом нөмірі және т.б.). Жойылатын заттарсыз теңдеуді қайта жазыңыз.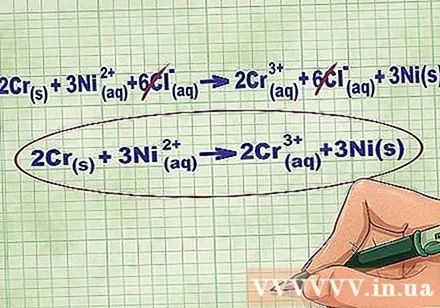
- Мысалды аяқтағаннан кейін бізде екі жағында теңгерімге жататын 6 тепе-теңдік ионы бар. Таза иондық теңдеу 2Cr құрайды(р) + 3Ni(dd) -> 2Cr(dd) + 3Ni(р).
- Егер сіз дұрыс болсаңыз, реакцияға түсетін жағындағы жалпы заряд таза иондық теңдеудегі өнім жағындағы зарядқа тең болуы керек.
Кеңес
- Сіз болмасаңыз, теңдеудегі барлық заттардың күйлерін жазыңыз болады ұпай жоғалту.